zzgl. MwSt.
- Virtual Classroom-Preis: 616,55 € zzgl. MwSt.
- Dauer: 1 Tag (von 09:00 - 17:00 Uhr)
- Servicebausteine: im Wert von 89.70 €
- Artikelnummer: S23
- Max. Teilnehmer: 15
- Kursform: Präsenz oder Virtual Classroom
- Seminarinfo: PDF-Download
- Inhouse: Ihre unverbindliche Anfrage
-
Nächste Termine:
Live Virtual-Classroom-Training - 15.05. - 15.05.25. Sven Beerheide
![Jetzt diesen Termin buchen!]()
Live Virtual-Classroom-Training - 16.09. - 16.09.25. Bernd Stadter
![Jetzt diesen Termin buchen!]()
Live Virtual-Classroom-Training - 14.11. - 14.11.25. Sven Beerheide
![Jetzt diesen Termin buchen!]()
Alle Termine anzeigen
-
-
Weitere Kursformate:
In dieser Schulung zum ISO 14971 Risikomanagement für Medizinprodukte lernen Sie, wie Sie die regulatorischen Anforderungen der EU Medizinprodukte Verordnung MDR 2017/745 unter Anwendung der DIN EN ISO 14971 umsetzen. Anschließend sind Sie in der Lage, ein Risikomanagementsystem aufzubauen sowie eine Risikoanalyse nach DIN EN ISO 14971 durchzuführen. Bedingt durch die EN ISO 13485 sowie die EU Medizinprodukteverordnung, wird ein funktionierendes Risikomanagement für Medizinprodukte immer wichtiger. Für die Risikobewertung müssen Sie dabei Patienten, Anwender und Dritte getrennt betrachten. Sie müssen eine Risikomanagementakte, in der die Betrachtung aller Gefährdungen und Begründungen hinsichtlich Entscheidungsfindungen zur Abstellung bzw. Akzeptanz von Risiken zu dokumentieren ist, erstellen. Weiterhin ist eine stetige Überwachung der Gültigkeit jeder Risikomanagementakte eine regulatorische Vorgabe.
In dieser Schulung zum ISO 14971 Risikomanagement für Medizinprodukte lernen Sie, wie Sie einen Risikomanagementplan erstellen und eine umfassenden Risikoanalyse auf Basis der EN ISO 14971 Anforderungen durchführen!

Kostenlos für Sie: Prozessbeschreibung Vorlage kostenlos - Prozessbeschreibung erstellen - Erfinden Sie das Rad nicht neu! Die Nutzung beinhaltet keine Folgeverpflichtungen, kein Abo und bedarf keiner Kündigung in irgendeiner Form! Details >
Was sind die Inhalte Ihrer Schulung ISO 14971 Risikomanagement für Medizinprodukte?
Sie lernen in diesem Seminar, wie Sie ein Risikomanagement gemäß der Medical Device Regulation - MDR unter Anwendung der DIN EN ISO 14971 aufbauen.
Was sind die grundlegenden regulatorischen Anforderungen an das Risikomanagement für Medizinprodukte gemäß MDR 2017/745?
Zuerst macht Ihr Trainer Sie mit den regulatorischen Vorgaben vertraut. In diesem Zuge lernen Sie auch wichtige Begriffe und Definitionen für den gesamten Risikomanagementprozess kennen.
- Die MDR - Verordnung (EU) 2017/745 über Medizinprodukte
- Wichtige Begriffe und ihre Definitionen
Was sind die Anforderungen an ein ISO 14971 Risikomanagement?
Anschließend erfahren Sie, wie Sie die regulatorischen Anforderungen mithilfe der DIN EN ISO 14971:2019 umsetzen. An dieser Stelle vermitteln wir Ihnen das Wissen, wie Sie Risiken für ein Medizinprodukt erkennen und diese im Rahmen eines gezielten Risikomanagements beherrschen können.
- Erstellung und Lenkung der Risikomanagementakte
- Verschiedene Verfahren der Risikoanalyse
- Der Risikomanagementplan
- Potenzielle und akute Gefährdungen für ein Medizinprodukt erkennen
- Risiken richtig einschätzen und verhindern
- Risikobewertung und Risikobeherrschung
- Bewertung des Restrisikos
- Risikomanagementbericht ISO 14971
- Überwachung nach dem Inverkehrbringen gemäß MDR - entdecken Sie hierzu auch unser passendes Virtual-Classroom-Training
Welches Zertifikat und welche Qualifikationsbescheinigung erhalten Sie nach dieser Schulung?
Sie erhalten eine Qualifikationsbescheinigung zur Teilnahme an dieser ISO 14971 Risikomanagement für Medizinprodukte Schulung in Deutsch sowie in Englisch. Die englische Qualifikationsbescheinigung ist dabei als Serviceleistung im Preis enthalten. Die Bescheinigung dokumentiert dabei die behandelten Inhalte sowie die Dauer der Schulung und dient Ihnen als Nachweis Ihrer Teilnahme.


Was ist das Ziel dieser Schulung ISO 14971 Risikomanagement...
Welche Zielgruppe sprechen wir mit diesem Seminar...
Voraussetzungen für die Teilnahme an dieser...
Was ist das Ziel dieser Schulung ISO 14971 Risikomanagement für Medizinprodukte?
Sie lernen in diesem Seminar, was Sie im Rahmen eines Risikomanagements für Medizinprodukte beachten müssen und wie Sie dieses entsprechend den relevanten gesetzlichen Vorgaben der MDR unter Anwendung der DIN EN ISO 14971 betreiben. Dabei befähigen wir Sie, eine Risikoanalyse durchzuführen. Sie können abschließend potenzielle und akute Gefährdungen feststellen, Risiken richtig einschätzen und verhindern.
Welche Zielgruppe sprechen wir mit diesem Seminar an?
Dieses Seminar richtet sich an alle Personen, die im Rahmen des Risikomanagements für ein Medizinprodukt verantwortlich sind und eine Risikoanalyse nach ISO 14971 durchführen müssen. Hierzu zählen beispielsweise Führungskräfte, Fachpersonal, QM-Beauftragte und Qualitätsleiter, die im Bereich von Medizinprodukten für den Aufbau von Qualitätsmanagement-Systemen, z. B. nach EN ISO 13485 und deren Weiterentwicklung verantwortlich sind.
Voraussetzungen für die Teilnahme an dieser Risikomanagement für Medizinprodukte Schulung
Für die Teilnahme an diesem Seminar zum ISO 14971 Risikomanagement für Medizinprodukte sind keine Voraussetzungen notwendig. Somit können Sie sich direkt anmelden.
Ihre Servicebausteine in diesem ISO 14971 Risikomanagement für Medizinprodukte - gemäß MDR 2017/745 Kurs:
Als Kursteilnehmer erhalten Sie folgende Servicebausteine im Rahmen Ihrer Kursteilnahme. Diese Bausteine sind im Seminarpreis bereits enthalten und unterstützen Sie mit zusätzlichen Inhalten und Musterdokumenten zu Ihrem Kursthema. Den monatlichen Expertenbrief erhalten Sie erstmalig im Anschluss an Ihre Teilnahme. Dieser informiert Sie monatlich über aktuelle Fachinfos zu Ihrem Kursthema.
| E-Kurs: | Erstellung einer Arbeitsanweisung - kostenloser E-Learning Im Wert von 39,90 € |
|
| Vorlagen: | Risikomanagementbericht ISO 14971 Im Wert von 24,90 € |
|
| Vorlagen: | Risikomanagementplan ISO 14971 Im Wert von 24,90 € |
|
| Fachinfo: | Ihr monatlicher Expertenbrief Exklusive Expertentipps und Fachwissen für Sie |
Weitere mögliche Schritte Ihrer Ausbildung
Im Bereich Qualitätsmanagement in der Medizinprodukteindustrie haben wir zahlreiche Schulungen sowie modulare Ausbildungsmöglichkeiten für Sie im Angebot. Bilden Sie sich jetzt umfassend in Ihrem persönlichen Themengebiet weiter! Nachfolgend haben wir einige Schulungsmöglichkeiten für Sie zusammen gestellt.
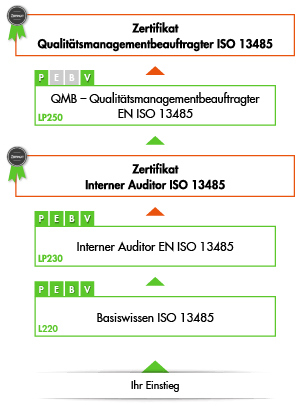
Ausbildung zum Qualitätsmanagementbeauftragten ISO 13485
Diese Ausbildung besteht aus drei Ausbildungsschritten bis hin zur Prüfung zum international anerkannten "Qualitätsmanagementbeauftragten ISO 13485". Sie können aber selbstverständlich auch jede Schulung einzeln besuchen, unabhängig von der Gesamtausbildung.
1. Schritt: Basiswissen Qualitätsmanagement ISO 13485
2. Schritt: Interner Auditor ISO 13485
3. Schritt: Qualitätsmanagementbeauftragter ISO 13485
Schulungen rund um das Qualitätsmanagement in der Medizinprodukte Industrie
Entdecken Sie auch unsere individuellen Seminare zu gezielten Themen und eignen Sie sich die erforderlichen Kenntnisse für die erfolgreiche Umsetzung in Ihrem eigenen Unternehmen an!
- Software Validierung / Computer System Validierung (CSV) in der Medizinprodukte Industrie
- MDSAP Audit für Hersteller von Medizinprodukten - Medical Device Single Audit Program
- CAPA Prozess für Medizinprodukte
- Prozess Validierung in der Medizinprodukte Industrie - Grundlagen
- Prozess Validierung in der Medizinprodukte Industrie - Grundlagen und Workshop
|
Seite 0 von 0
|