zzgl. MwSt.
- Virtual Classroom-Preis: 616,55 € zzgl. MwSt.
- Dauer: 1 Tag (von 09:00 - 17:00 Uhr)
- Servicebausteine: im Wert von 399.80 €
- Artikelnummer: S229
- Max. Teilnehmer: 15
- Kursform: Präsenz oder Virtual Classroom
- Seminarinfo: PDF-Download
- Inhouse: Ihre unverbindliche Anfrage
-
Nächste Termine:
Live Virtual-Classroom-Training - 27.03. - 27.03.25. Erwin Fredel
![Jetzt diesen Termin buchen!]()
Pforzheim Parkhotel - 27.03. - 27.03.25. Erwin Fredel
![Jetzt diesen Termin buchen!]()
Live Virtual-Classroom-Training - 17.10. - 17.10.25. Oliver Kirn
![Jetzt diesen Termin buchen!]()
Frankfurt NH Hotel Airport - 17.10. - 17.10.25. Oliver Kirn
![Jetzt diesen Termin buchen!]()
Alle Termine anzeigen
-
-
Weitere Kursformate:
Der CAPA Prozess (Corrective and Preventive Action) ist ein Prozess im Qualitätsmanagement für ein Korrekturmaßnahmen und Vorbeugungsmaßnahmen System und ist Teil eines GMP-konformen Arbeitens (good manufacturing process). Angewendet wird ein CAPA Prozess also, um mit aufgetretenen Fehlern oder Abweichungen umzugehen und diese zu beheben (Korrektur) sowie zukünftige Fehler und Abweichungen zu verhindern (Vorbeugung). Im Bereich der Medizinprodukte werden in der Norm EN ISO 13485 die Korrekturmaßnahmen und Vorbeugemaßnahmen in getrennten Kapiteln behandelt. Daher wird in der Norm der CAPA-Prozess als solcher nicht explizit genannt - da normativ jedoch die Dokumentation und Bewertung der Korrektur- und Vorbeugemaßnahmen gefordert wird, ist die Einführung eines CAPA Systems ideal, da es die beiden Prozesse miteinander vereint.
Lernen Sie in unserer 1-tägigen CAPA Prozess Schulung, wie Sie ein CAPA System für Medizinprodukte erfolgreich in Ihren Betrieb implementieren! Wir zeigen Ihnen dabei, wie Sie den CAPA Prozess systematisch zur Verbesserung der Produktqualität anwenden können und einen maximalen Nutzen daraus erzielen. Sie lernen, welche Anforderungen Sie berücksichtigen müssen und erfahren viele praktische Methoden und Beispiele zur Umsetzung Ihres effektiven CAPA Systems. So sind Sie bestens für alle Herausforderungen gewappnet!

Kostenlos für Sie: Prozessbeschreibung Vorlage kostenlos - Prozessbeschreibung erstellen - Erfinden Sie das Rad nicht neu! Die Nutzung beinhaltet keine Folgeverpflichtungen, kein Abo und bedarf keiner Kündigung in irgendeiner Form! Details >
Was sind die Inhalte Ihrer Schulung zum CAPA Prozess?
Sie lernen in diesem Seminar den gesamten CAPA-Prozess kennen - beginnend mit dem Auftreten einer Abweichung, über die Analyse der Ursachen bis hin zur Durchführung der Korrekturmaßnahme sowie der Prüfung derer Wirksamkeit. Weiterhin zeigen wir Ihnen, wie der gesamte CAPA Prozess dokumentiert wird.
- Einführung in den Corrective and Preventive Action Prozess
- Nationale und internationale gesetzliche und normative Grundlagen für CAPA
- Das CAPA System - Aufbau und Bestandteile
- Einführung eines CAPA Systems
- Methoden der Ursachenanalyse und Risikoanalyse
- Anforderungen an die Dokumentation
- Nachweis der Wirksamkeit des CAPA Systems
Welches Zertifikat und welche Qualifikationsbescheinigung erhalten Sie nach dieser Schulung zum CAPA Prozess?
Sie erhalten eine Qualifikationsbescheinigung zur Teilnahme am Seminar in Deutsch sowie in Englisch. Die englische Qualifikationsbescheinigung ist dabei als Serviceleistung im Preis enthalten. Die Bescheinigung dokumentiert dabei die behandelten Inhalte sowie die Dauer der Schulung und dient Ihnen als Nachweis Ihrer Teilnahme an der Schulung.


Was ist das Ziel dieser Schulung zum CAPA Prozess für...
Welche Zielgruppe sprechen wir mit diesem Seminar...
Voraussetzungen für die Teilnahme an dieser CAPA System...
Was ist das Ziel dieser Schulung zum CAPA Prozess für Medizinprodukte?
Wir zeigen Ihnen in dieser Schulung, welche Anforderungen Sie bei der Einführung des CAPA Systems berücksichtigen müssen, wie Sie den CAPA-Prozess erfolgreich in Ihrem Betrieb zum Einsatz bringen, geeignete Korrektur- und Vorbeugungsmaßnahmen bei einer Abweichung ergreifen und den CAPA-Prozess dabei angemessen dokumentieren!
Welche Zielgruppe sprechen wir mit diesem Seminar an?
Dieses Seminar zum CAPA Prozess richtet sich an Fachkräfte und Beauftragte des Qualitätsmanagements, Fach- und Führungskräfte aus Unternehmen der Medizinprodukteindustrie, Zulassungsbeauftragte (Regulatory Affairs) sowie Sicherheitsbeauftragte.
Voraussetzungen für die Teilnahme an dieser CAPA System Schulung
In diesem Seminar zum CAPA Prozess für Medizinprodukte werden Grundkenntnisse im Qualitätsmanagementsystem nach EN ISO 13485 und / oder FDA 21 CFR 820 vorausgesetzt.
Ihre Servicebausteine in diesem CAPA Prozess für Medizinprodukte Kurs:
Als Kursteilnehmer erhalten Sie folgende Servicebausteine im Rahmen Ihrer Kursteilnahme. Diese Bausteine sind im Seminarpreis bereits enthalten und unterstützen Sie mit zusätzlichen Inhalten und Musterdokumenten zu Ihrem Kursthema. Den monatlichen Expertenbrief erhalten Sie erstmalig im Anschluss an Ihre Teilnahme. Dieser informiert Sie monatlich über aktuelle Fachinfos zu Ihrem Kursthema.
| E-Kurs: | KVP Online Kurs - Kontinuierlicher Verbesserungsprozess Wissen kompakt Im Wert von 299,90 € |
|
| Vorlagen: | KVP Startpaket - alle Vorlagen zur KVP Einführung Im Wert von 99,90 € |
|
| Fachinfo: | Ihr monatlicher Expertenbrief Exklusive Expertentipps und Fachwissen für Sie |
Weitere mögliche Schritte Ihrer Ausbildung
Im Bereich Qualitätsmanagement in der Medizinprodukteindustrie haben wir zahlreiche Schulungen sowie modulare Ausbildungsmöglichkeiten für Sie im Angebot. Bilden Sie sich jetzt umfassend in Ihrem persönlichen Themengebiet weiter! Nachfolgend haben wir einige Schulungsmöglichkeiten für Sie zusammen gestellt.
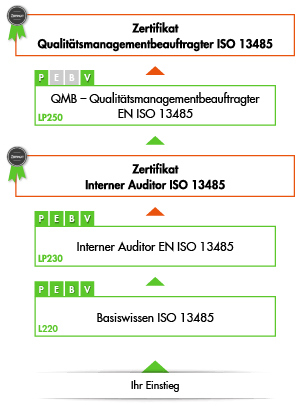
Ausbildung zum Qualitätsmanagementbeauftragten ISO 13485
Diese Ausbildung besteht aus drei Ausbildungsschritten bis hin zur Prüfung zum international anerkannten "Qualitätsmanagementbeauftragten ISO 13485". Sie können aber selbstverständlich auch jede Schulung einzeln besuchen, unabhängig von der Gesamtausbildung.
1. Schritt: Basiswissen Qualitätsmanagement ISO 13485
2. Schritt: Interner Auditor ISO 13485
3. Schritt: Qualitätsmanagementbeauftragter ISO 13485
Schulungen rund um das Qualitätsmanagement in der Medizinprodukteindustrie
Entdecken Sie auch unsere individuellen Seminare zu gezielten Themen und eignen Sie sich die erforderlichen Kenntnisse für die erfolgreiche Umsetzung in Ihrem eigenen Unternehmen an!
- Software Validierung / Computer System Validierung (CSV) in der Medizinprodukteindustrie
- MDSAP Seminar - Anforderungen an ein MDSAP Audit für Medizinproduktehersteller
- Prozess Validierung in der Medizinprodukte Industrie - Grundlagen
- Prozess Validierung in der Medizinprodukte Industrie - Grundlagen und Workshop
|
Seite 0 von 0
|