zzgl. MwSt.
- Virtual Classroom-Preis: 616,55 € zzgl. MwSt.
- Dauer: 1 Tag (von 09:00 - 17:00 Uhr)
- Servicebausteine: im Wert von 249.80 €
- Artikelnummer: S231
- Max. Teilnehmer: 15
- Kursform: Präsenz oder Virtual Classroom
- Seminarinfo: PDF-Download
- Inhouse: Ihre unverbindliche Anfrage
-
Nächste Termine:
Live Virtual-Classroom-Training - 16.05. - 16.05.25. Sven Beerheide
![Jetzt diesen Termin buchen!]()
Live Virtual-Classroom-Training - 29.08. - 29.08.25. Sven Beerheide
![Jetzt diesen Termin buchen!]()
Live Virtual-Classroom-Training - 07.11. - 07.11.25. Sven Beerheide
![Jetzt diesen Termin buchen!]()
Alle Termine anzeigen
-
-
Weitere Kursformate:
In diesem MDSAP Seminar machen wir Sie mit den Hintergründen, Zielen sowie Anforderungen eines MDSAP Audits vertraut. Das MDSAP - Medical Device Single Audit Program ist eine vom International Medical Device Regulators Forum (IMDRF) ins Leben gerufene internationale Initiative zur Vereinheitlichung von Anforderungen an Qualitätsmanagementsysteme in der Medizinprodukteindustrie und zur Gestaltung einer einheitlichen Vorgehensweise bei Qualitätsmanagement Audits von Medizinprodukteherstellern. Der dabei im Rahmen von MDSAP geschaffene einheitliche Standard wird von mehreren Ländern anerkannt. So kann der Marktzugang zu diesen Ländern für Medizinprodukte Hersteller erleichtert werden, indem die Anzahl an Qualitätsmanagement Audits durch Behörden dieser Länder reduziert wird. Aktuell gelten die MDSAP-Standards für die Länder Australien, Brasilien, Japan, Kanada und die USA. Das Audit wird von speziell autorisierten auditierenden Organisationen durchgeführt.
Lernen Sie in diesem MDSAP Seminar, was sich hinter einem solchen Audit verbirgt und welche MDSAP Anforderungen Hersteller von Medizinprodukten im Rahmen dieser Audits beachten müssen! Wir ermöglichen Ihnen im Rahmen dieses Seminars einen allgemeinen Einblick in das Medical Device Single Audit Program und in die wichtigsten länderspezifischen Besonderheiten der einzelnen teilnehmenden Länder und zeigen Ihnen die Unterschiede zu herkömmlichen Qualitätsmanagement Audits nach EN ISO 13485 sowie die spezifischen MDSAP Anforderungen auf. Sie lernen in dieser MDSAP Schulung das Audit Modell und die Ziele kennen und wie Sie sich auf ein solches Audit vorbereiten können. Durch praktische Beispiele wird in Ihnen das Audit Modell näher gebracht, sodass Sie nach diesem MDSAP Seminar bestens für das Medical Device Single Audit Program gerüstet sind!

Kostenlos für Sie: Prozessbeschreibung Vorlage kostenlos - Prozessbeschreibung erstellen - Erfinden Sie das Rad nicht neu! Die Nutzung beinhaltet keine Folgeverpflichtungen, kein Abo und bedarf keiner Kündigung in irgendeiner Form! Details >
Was sind die Inhalte in Ihrem MDSAP Seminar?
Lernen Sie im Rahmen dieses Seminars in nur einem Tag, was sich hinter den MDSAP Anforderungen für Medizinproduktehersteller verbirgt und wie Sie sich auf ein solches Audit vorbereiten können. Durch die Verbindung von Theorie und Praxisbeispielen werden Sie dabei bestmöglich auf die selbstständige Umsetzung des Gelernten im eigenen Unternehmen vorbeireitet.
Die Hintergründe
- Das Konzept vom Medical Device Single Audit Program
- Ziele eines MDSAP Audits
- Teilnehmende Zulassungsbehörden / Länder
- Worin besteht der Unterschied zu den bisher bekannten EN ISO 13485 Audits?
Das MDSAP Audit Modell
Lernen Sie anschließend in diesem MDSAP Seminar die gesamte Vorgehensweise im Rahmen des Audits kennen und festigen Sie Ihr erworbenes Wissen durch praktische Beispiele.
- Vorgehen bei einem MDSAP-Audit
- MDSAP Anforderungen und Inhalte
- Standardisierte Definition von Abweichungen
- Vorbereitung und Durchführung
- Umgang mit Auditergebnissen
- Vorteile für Hersteller von Medizinprodukten: Einsparung von Zeit und Kosten
- Praktische Beispiele
Welches Zertifikat und welche Qualifikationsbescheinigung erhalten Sie nach diesem MDSAP Seminar zu den MDSAP Audit Anforderungen?
Sie erhalten eine Qualifikationsbescheinigung zur Teilnahme am MDSAP Seminar in Deutsch sowie in Englisch. Die englische Qualifikationsbescheinigung ist dabei als Serviceleistung im Preis enthalten. Die Qualifikationsbescheinigung dokumentiert dabei die behandelten Inhalte sowie die Schulungsdauer und dient Ihnen als Nachweis Ihrer Teilnahme an der Schulung.


Was ist das Ziel in diesem MDSAP Seminar?In diesem MDSAP...
Welche Zielgruppe sprechen wir mit dieser Schulung...
Voraussetzungen für die Teilnahme an dieser MDSAP Audit...
Was ist das Ziel in diesem MDSAP Seminar?
In diesem MDSAP Seminar erwerben Sie das Wissen und die Kenntnisse, um Ihre Organisation erfolgreich auf ein MDSAP-Audit vorbereiten zu können. Zudem lernen Sie das Audit Modell kennen sowie die wichtigsten länderspezifischen MDSAP Audit Anforderungen und Hintergründe über das Konzept.
Welche Zielgruppe sprechen wir mit dieser Schulung an?
Diese Schulung richtet sich an (verantwortliche) Mitarbeiter von Herstellern von Medizinprodukten und Exporteuren in den Bereichen Qualitätsmanagement, Regulatory Affairs, Foreign Affairs sowie interne Audits.
Voraussetzungen für die Teilnahme an dieser MDSAP Audit Schulung
In diesem MDSAP Seminar werden die Kenntnisse und idealerweise praktische Erfahrungen mit Qualitätsmanagementsystemen nach EN ISO 13485 vorausgesetzt.
Ihre Servicebausteine in diesem MDSAP Seminar - Anforderungen an ein MDSAP Audit für Medizinproduktehersteller Kurs:
Als Kursteilnehmer erhalten Sie folgende Servicebausteine im Rahmen Ihrer Kursteilnahme. Diese Bausteine sind im Seminarpreis bereits enthalten und unterstützen Sie mit zusätzlichen Inhalten und Musterdokumenten zu Ihrem Kursthema. Den monatlichen Expertenbrief erhalten Sie erstmalig im Anschluss an Ihre Teilnahme. Dieser informiert Sie monatlich über aktuelle Fachinfos zu Ihrem Kursthema.
| E-Kurs: | Interne Audits Wissen kompakt - E-Learning Im Wert von 149,90 € |
|
| Vorlagen: | Handbuch fuer interne Audits nach ISO 19011 fuer den internen Auditor Im Wert von 99,90 € |
|
| Fachinfo: | Ihr monatlicher Expertenbrief Exklusive Expertentipps und Fachwissen für Sie |
Weitere mögliche Schritte Ihrer Ausbildung
Im Bereich Qualitätsmanagement in der Medizinprodukteindustrie haben wir zahlreiche Schulungen sowie modulare Ausbildungsmöglichkeiten für Sie im Angebot. Bilden Sie sich jetzt umfassend in Ihrem persönlichen Themengebiet weiter! Nachfolgend haben wir einige Schulungsmöglichkeiten für Sie zusammen gestellt.
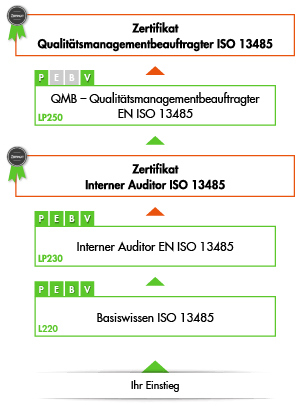
Ausbildung zum Qualitätsmanagementbeauftragten ISO 13485
Diese Ausbildung besteht aus drei Ausbildungsschritten bis hin zur Prüfung zum international anerkannten "Qualitätsmanagementbeauftragten ISO 13485". Sie können aber selbstverständlich auch jede Schulung einzeln besuchen, unabhängig von der Gesamtausbildung.
1. Schritt: Basiswissen Qualitätsmanagement ISO 13485
2. Schritt: Interner Auditor ISO 13485
3. Schritt: Qualitätsmanagementbeauftragter ISO 13485
Schulungen rund um das Qualitätsmanagement in der Medizinprodukteindustrie
Entdecken Sie auch unsere individuellen Seminare zu gezielten Themen und eignen Sie sich die erforderlichen Kenntnisse für die erfolgreiche Umsetzung in Ihrem eigenen Unternehmen an!
|
Seite 0 von 0
|